Virale luftvejsinfektioner er almindelige og ofte selv
limiterende, men for patienter med astma er de den hyppigste årsag til akut forværring. En begyndende forståelse af de uhensigtsmæssige signalveje, der aktiveres ved en virusinfektion hos disse patienter, åbner i dag nye muligheder for både forebyggelse og behandling
af astma. I denne artikel beskrives disse signalveje og de potentielle behandlingsmuligheder.
VIRALE INFEKTIONER ER EN
HYPPIG ÅRSAG TIL AKUT ASTMA
Akut astmaforværring defineres i Danmark efter guidelines fra British Thoracic Society som: 1) tiltagende symptomer (åndenød, pibende vejrtrækning, trykken for brystet og hoste) og 2) fald i lungefunktion målt ved enten peak flow eller spirometri. Virale luftvejsinfektioner er den hyppigste udløsende årsag [1]. Med moderne polymerasekæde (PCR)-baserede teknikker kan man påvise virus hos 60-80% af patienterne [2]. Der er ikke noget, der tyder på, at personer med astma oftere får virusinfektioner end personer uden astma, men der er derimod tydelig evidens for, at de får langt sværere og længerevarende symptomer med hyppig involvering af de nedre luftveje [3].
Langt den hyppigste virus i forbindelse med akut astma er humant rhinovirus (HRV), men der påvises også influenza, parainfluenza, respiratorisk syncytialvirus, metapneumovirus, corona-, adeno- og bocavirus [2].

Der findes over 150 serotyper af HRV. De grupperes på baggrund af fylogenetiske ligheder i grupperne A, B og C, hvor den sidstnævnte først blev opdaget efter udbredelsen af PCR-teknikker, idet HRV-C ikke kan opformeres i sædvanlige cellekulturer. HRV-C er især undersøgt hos børn og er fundet hos overraskende mange børn, der var indlagt med respiratorisk hvæsen. Det har rejst mistanken om, at denne serotype i højere grad end typerne A og B kan inducere et inflammatorisk respons, der medfører forværring af astma [4]. HRV-C er kun sparsomt undersøgt hos voksne.
I forhold til HRV påvises de øvrige virus relativt sjældent og med stor variation mellem enkelte studier. Influenza rapporteres hos 0-32% af voksne med astmaeksacerbation [1, 2, 5]. Under H1N1-pandemien i 2009 var astma dog den hyppigste komorbiditet hos patienter med indlæggelseskrævende sygdom, hvilket tyder på, at personer med astma bliver mere syge af H1N1 end personer uden astma [6]. Sundhedsstyrelsen anbefaler influenzavaccination til patienter med behandlingskrævende astma. I et Cochranereview fra 2013 med 18 randomiserede undersøgelser konkluderede man dog, at der ikke var overbevisende effekt på hverken sværhedsgraden eller antallet af influenzarelaterede astmaeksacerbationer [7].
VIRALE INFEKTIONER OG ASTMAFÆNOTYPER
Astma er en meget heterogen sygdom med stor varia-tion i sygdomspræsentationen. Man har derfor forsøgt at definere flere undergrupper, såkaldte fænotyper, på baggrund af disse kliniske karakteristika. Klassisk har man skelnet mellem allergisk og ikkeallergisk astma ud fra tilstedeværelsen af luftvejsallergier. I de senere år har fokus været på typen af luftvejsinflammation, hvor astma deles op i eosinofil astma, som ofte er allergisk, og noneosinofil astma [8]. Sammenhængen mellem virusinfektion og astma er hovedsageligt undersøgt hos ikkerygende patienter med allergisk astma. Mindst halvdelen af patienterne med astma er imidlertid ikke allergiske og udgør en meget forskelligartet gruppe. Hvorvidt virusinfektioner har en større eller mindre betydning for patienter med ikkeallergisk astma, er uvist, og der er i det hele taget brug for flere studier af patofysiologien ved den ikkeallergiske astma og ved noneosinofil versus eosinofil astma.
DEFEKTER I DET INNATE ANTIVIRALE
IMMUNRESPONS VED ASTMA
Patienter med astma oplever langt større sygdom i forbindelse med øvre luftvejs-infektioner, som f.eks. almindelig forkølelse, end andre. Det har ført til hypotesen om et defekt antiviralt immunrespons hos patienter med astma.
Der har været en stigende forskningsinteresse på området i de seneste år, og studier har vist både strukturelle og funktionelle defekter i luftvejsepitelet samt specifikke defekter i det innate immunsystem hos patienter med astma. Inhalerede viruspartikler lander på luftvejsepitelet, der er forbundet med tight junctions, som udgør en effektiv barriere mod alle inhalerede patogener [9].
Selv mellem forværringer kan der påvises nedsat epitelial barrierefunktion hos patienter med astma, bl.a. i form af defekte tight junctions [10]. Det eksponerer de basale lag i epitelet, der således er mere modtagelige over for virusinfektion [11]. Konventionel inflammationsdæmpende astmabehandlig øger epitelets integritet [12], hvilket kan forklare den kliniske observation, at patienter, der har astma og opnår god inflammationskontrol under behandling med inhalationssteroid, ikke længere får eksacerbationer i forbindelse med øvre luftvejsinfektioner.
Selve immunresponset mod virale infektioner synes også at være ændret hos patienter med astma. En lang række cytokiner, kemokiner og vækstfaktorer er fundet i højere niveau hos patienter med astma end hos raske. I de følgende afsnit gennemgås de signalveje, der specifikt forbinder viral infektion med akut astmaforværring.
Virus binder til overfladereceptorer på epitelcellerne, f.eks. intercellular adhesion molecule 1 (ICAM-1), for de fleste HRV. Intracellulært genkendes det virale RNA af en række pattern recognition receptors (PRR), bl.a. fra familien toll-like receptors (TLR). Ved astma ses imidlertid en ændret ekspression af TLR-receptorer. Patienter med astma har et højere niveau af TLR3 under virale infektioner end raske [13], og TLR3 anses derfor som muligt terapeutisk mål og undersøges i øjeblikket i et fase 1-studie, hvor patienter med astma randomiseres til et TLR3-neutraliserende antistof og derefter udsættes for eksperimentel HRV-infektion.
Et andet potentielt mål er ICAM-1, men en total blokade kan være problematisk, idet receptoren indgår i en række nødvendige processer, herunder tiltrækningen af neutrofile granulocytter [14]. Et nyligt publiceret studie har dog vist, at det måske er muligt at blokere et domæne af receptoren, der tilsyneladende kun bruges af HRV, hvorved receptorens øvrige funktioner ikke påvirkes [15].
INTERFERONER
Ved aktivering af PRR opreguleres en række transkriptionsfaktorer, hvilket bl.a. øger dannelsen af interferoner (IFN), der medierer apoptose af inficerede celler som en del af det normale forsvarsrespons ved virusinfektion. Patienter med astma synes imidlertid at
have en nedsat produktion af IFN.
IFN er en essentiel del af det innate antivirale respons og inddeles ofte i type I (IFN-a/b), type II (IFN-g) og type III (IFN-l). Bronkiale epitelceller fra patienter, der har astma og er inficeret in vitro med HRV, producerer mindre IFN type I [16] og type III [17] end tilsvarende celler fra raske kontrolpersoner.
Den nedsatte produktion af interferon er muligvis relateret til allergisk sensibilisering. I et studie af influenza A fandt man således en omvendt korrelation mellem ekspression af immunglobulin (Ig)E-højaffinitetsreceptoren FceR1 og produktionen af IFN-a, hvilket tyder på, at et højt IgE-niveau er associeret til en lavere interferonproduktion. Efterfølgende tilsatte man IgE for at krydsbinde receptoren og dermed simulere et allergisk stimulus og kunne konstatere, at produktionen af IFN-a ophørte helt [18].
Sammenhængen mellem allergi og eksacerbation udløst af virusinfektion underbygges i et studie af af Green et al med voksne patienter med astma. Studiet
viste, at den største risiko for eksacerbation sås, når viral infektion og udsættelse for allergener skete samtidigt [19].
Nedsat interferonproduktion er således muligvis kun af betydning for visse grupper af patienter med astma, ligesom der kan være en association til graden af sygdomskontrol. Således har man i andre studier kun fundet nedsat IFN-produktion hos underbehandlede patienter [20], og i andre igen har man påvist en positiv korrelation mellem enkelte interferoner og graden af symptomer [21]. Tilsætning af IFN-b og IFN-l1 hæmmer hver især replikationen af HRV in vitro [22], og virkningen af inhaleret IFN-b undersøges i øjeblikket i et fase 2-studie. IFN-l1 er en interessant mulighed for systemisk behandling, idet receptorerne kun findes på epitel- og dendritceller, hvorfor risikoen for systemiske bivirkninger muligvis er mindre.
FRA VIRAL INFEKTION TIL EOSINOFIL INFLAMMATION
Et effektivt immunrespons mod virale infektioner indeholder både et innat respons, som beskrevet ovenfor, og et adaptivt respons med tiltrækning af Th1-celler, der ved antigengenkendelse producerer yderligere interferoner og aktiverer lokale makrofager og cytotoksiske T-celler.
Inflammationen i luftvejene hos patienter med astma er imidlertid primært karakteriseret af en akkumulering af eosinofile granulocytter og mastceller, som er drevet af en aktivering af Th2-celler. Det står endnu ikke klart, hvilke signalveje der fører fra denne viralt udløste immunaktivitet til den Th2-type-inflammation med eosinofili, der ellers primært forbindes med allergisk aktivitet.
I en mulig signalvej indgår cytokinet thymic stromal lymphopoietin (TSLP), der bl.a. produceres af bronkiale epitelceller og øger differentieringen af naive T-celler til modne Th2-celler [23] (Figur 1). Mængden af TSLP er højere hos patienter med astma og stiger kraftigere end hos raske ved viral infektion [24]. Studier med mus har vist, at anti-TSLP-antistoffer reducerer luftvejsinflammation og forhindrer remodellering af luftvejene i en model, hvor astma induceres ved indånding af proteinet ovalbumin [25]. Samlet set er TSLP derfor et interessant mål for immunterapi, og studier med humant monoklonalt anti-TSLP-antistof er i øjeblikket i fase 2.
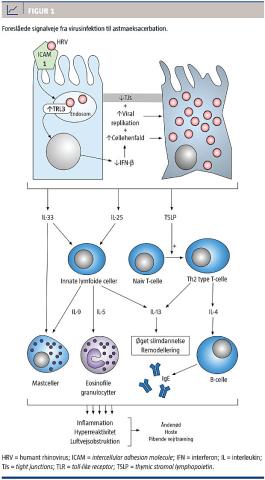
Ved virusinfektion udskiller luftvejsepitelet også cytokinerne interleukin (IL)-25 og IL-33, der begge fremmer et Th2-respons. Niveauet af begge cytokiner er øget hos patienter med astma og korrelerer med sværhedsgraden af symptomer [26, 27]. IL-33 øger rekrutteringen af mastceller og øger sammen med IL-25 produktionen af yderligere proallergiske cytokiner (IL-4, -5, -9 samt -13) og fremmer rekrutteringen af eosinofile granulocytter fra cirkulationen [28]. Monoklonale antistoffer mod hhv. IL-4, -5, -13 og for ganske nylig -33 er alle under klinisk afprøvning.
Det eneste antistof, der i øjeblikket er godkendt til astmabehandling, er omalizumab, der er et monoklonalt anti-IgE-antistof til svær allergisk astma. Behandlingen reducerer antallet af eksacerbationer, daglige symptomer og steroidbehov hos en nøje udvalgt patientgruppe [29, 30].
Man har endvidere observeret, at sæsonvariationen i eksacerbationsraten forsvinder under behandlingen. Patienterne har allergi over for helårlige allergener, så den ophævede sæsonvariation i vinterhalvåret kan muligvis tilskrives færre viralt inducerede eksacerbationer som følge af bedre innat antiviralt respons, jf. ovenstående afsnit.
KONKLUSION
Virusinfektioner spiller en central rolle i akut forværring af astma. De seneste års forskning har øget vores forståelse af patogenesen ved at vise, at luftvejsepitelets barrierefunktion er nedsat hos patienter med astma, og at det immunologiske respons mod virusinfektioner er uhensigtsmæssigt og ineffektivt. Allergisk sensibilisering synes at påvirke det immunologiske respons mod viral infektion, men det er endnu uvist, om virusinfektioner har samme betydning hos alle patienter med astma, herunder patienter med ikkeallergisk astma.
Nye lægemidler mod astma målrettes i dag specifikke signalveje i både det innate og det adaptive immunsystem. Udviklingen går således mod en individuelt tilpasset behandling, hvor nøjagtig beskrivelse af patientens inflammatoriske profil bliver essentiel.
Korrespondance: Asger Bjerregaard, Lungemedicinsk Forskningsenhed, Lungemedicinsk Afdeling L, Bispebjerg Hospital, Bispebjerg Bakke 23, 2400 København NV. E-mail: asgerbg@gmail.com
Antaget: 19. maj 2014
Publiceret på Ugeskriftet.dk: 1. september 2014
Interessekonflikter: ingen.
<h2>LITTERATUR</h2>
<ol type="d">
<li><p><span style="font-size: 6.5pt; ">Nicholson KG, Kent J, Ireland DC. Respiratory viruses and exacerbations of asthma in adults. BMJ 1993;307:982-6. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Grissell TV, Powell H, Shafren DR et al. Interleukin-10 gene expression in acute virus-induced asthma. Am J Respir Crit Care Med 2005;172: 433-9. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Corne JM, Marshall C, Smith S et al. Frequency, severity, and duration of rhinovirus infections in asthmatic and non-asthmatic individuals: a longitudinal cohort study. Lancet 2002;359:831-4. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Bizzintino J, Lee W-M, Laing IA et al. Association between human rhinovirus C and severity of acute asthma in children. Eur Respir J 2011;37: 1037-42. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Wark PAB, Johnston SL, Moric I et al. Neutrophil degranulation and cell <br>lysis is associated with clinical severity in virus-induced asthma. Eur Respir J 2002;19:68-75. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Jain S, Kamimoto L, Bramley AM et al. Hospitalized patients with 2009 H1N1 influenza in the United States, April-June 2009. N Engl J Med 2009;361:1935-44. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Cates CJ, Jefferson TO, Bara AI et al. Vaccines for preventing influenza in people with asthma. Cochrane Database Syst Rev 2000;4:CD000364. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Gibson PG. Inflammatory phenotypes in adult asthma: clinical applications. Clin Respir J 2009;3:198-206. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Holgate ST. The sentinel role of the airway epithelium in asthma pathogenesis. Immunol Rev 2011;242:205-19. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Swindle EJ, Collins JE, Davies DE. Breakdown in epithelial barrier function in patients with asthma: identification of novel therapeutic approaches. <br>J Allergy Clin Immunol 2009;124:23-34, 35-6. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Jakiela B, Brockman-Schneider R, Amineva S et al. Basal cells of differentiated bronchial epithelium are more susceptible to rhinovirus infection. Am J Respir Cell Mol Biol 2008;38:517-23. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Sekiyama A, Gon Y, Terakado M et al. Glucocorticoids enhance airway <br>epithelial barrier integrity. Int Immunopharmacol 2012;12:350-7. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Wood LG, Simpson JL, Wark PAB et al. Characterization of innate immune signalling receptors in virus-induced acute asthma. Clin Exp Allergy 2011;41:640-8. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Prince JE, Brayton CF, Fossett MC et al. The differential roles of LFA-1 and Mac-1 in host defense against systemic infection with Streptococcus pneumonia. J Immunol 2001;166:7362-9. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Traub S, Nikonova A, Carruthers A et al. An anti-human ICAM-1 antibody in-hibits rhinovirus-induced exacerbations of lung inflammation. PLoS Pathog 2013;9:e1003520. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Durrani SR, Montville DJ, Pratt AS et al. Innate immune responses to rhinovirus are reduced by the high-affinity IgE receptor in allergic asthmatic children. J Allergy Clin Immunol 2012;130:489-95. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Contoli M, Message SD, Laza-Stanca V et al. Role of deficient type III interferon-lambda production in asthma exacerbations. Nat Med 2006;12: 1023-6. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Gill MA, Bajwa G, George TA et al. Counterregulation between the Fc</span><span style="font-size: 6.5pt; font-family: 'Times New Roman'; ">γ</span><span style="font-size: 6.5pt; ">RI pathway and antiviral responses in human plasmacytoid dendritic cells. <br>J Immunol 2010;184:5999-6006. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Green RM, Custovic A, Sanderson G et al. Synergism between allergens and viruses and risk of hospital admission with asthma: case-control study. BMJ 2002;324:763. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Sykes A, Macintyre J, Edwards MR et al. Rhinovirus-induced interferon production is not deficient in well controlled asthma. Thorax 2014;69: 240-6. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Miller EK, Hernandez JZ, Wimmenauer V et al. A mechanistic role for type <br>III IFN-l1 in asthma exacerbations mediated by human rhinoviruses. Am J Respir Crit Care Med 2012;185:508-16. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Becker TM, Durrani SR, Bochkov YA et al. Effect of exogenous interferons on rhinovirus replication and airway inflammatory responses. Ann Allergy Asthma Immunol 2013;111:397-401. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Soumelis V, Reche PA, Kanzler H et al. Human epithelial cells trigger dendritic cell mediated allergic inflammation by producing TSLP. Nat Immunol 2002;3:673-80. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Sebastian K, Borowski A, Kuepper M et al. Signal transduction around thymic stromal lymphopoietin (TSLP) in atopic asthma. Cell Commun Signal 2008;6:5. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Chen Z-G, Zhang T-T, Li H-T et al. Neutralization of TSLP inhibits airway <br>re-modeling in a murine model of allergic asthma induced by chronic <br>exposure to house dust mite. PLoS One 2013;8:e51268. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Préfontaine D, Lajoie-Kadoch S, Foley S et al. Increased expression of IL-33 in severe asthma: evidence of expression by airway smooth muscle cells. J Immunol 2009;183:5094-103. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Wang Y-H, Angkasekwinai P, Lu N et al. IL-25 augments type 2 immune responses by enhancing the expansion and functions of TSLP-DC-<br>activated Th2 memory cells. J Exp Med 2007;204:1837-47. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Gregory LG, Jones CP, Walker SA et al. IL-25 drives remodelling in allergic airways disease induced by house dust mite. Thorax 2013;68:82-90. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Busse WW, Morgan WJ, Gergen PJ et al. Randomized trial of omalizumab (anti-IgE) for asthma in inner-city children. N Engl J Med 2011;364:1005-15. </span></p></li>
<li><p><span style="font-size: 6.5pt; ">Bousquet J, Cabrera P, Berkman N et al. The effect of treatment with omalizumab, an anti-IgE antibody, on asthma exacerbations and emergency medical visits in patients with severe persistent asthma. Allergy 2005;60:302-8.</span></p></li>
</ol>
Upper respiratory tract infections with common virusses is the most frequent cause of asthma exacerbations. Numerous defects in both epithelial function, pathogen recognition and innate immune signalling has been demonstrated in patients with asthma. The subject of this review is these recent findings and the potential therapeutic targets that are being identified.